艾日布林详细说明书
【通用名称】 艾日布林Halaven
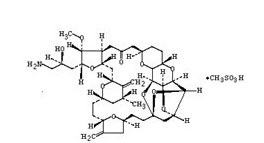
【英文名称】 Halaven(eribulin mesylate)
【中文名称】 甲磺酸艾日布林,甲磺酸艾瑞布林
治疗适应症
HALAVEN用于治疗局部晚期或转移性乳腺癌的成年患者,其在至少一种用于晚期疾病的化疗方案后进展(参见5.1节)。先前的治疗应该在佐剂或转移性环境中包括蒽环类抗生素和紫杉烷,除非患者不适合这些治疗。
HALAVEN用于治疗不能切除的脂肪肉瘤的成年患者,其已接受先前使用蒽环类药物治疗(除非不适合)用于晚期或转移性疾病(见第5.1节)。
用法用量
HALAVEN只能在经过适当使用细胞毒性药用产品的合格医师的监督下进行。
剂量学
擦拭剂作为即用型溶液的推荐剂量为1.23mg / m 2,其应在每21天周期的第1天和第8天静脉注射2至5分钟。
请注意:
在欧盟,推荐剂量是指活性物质(eribulin)的基础。要给予患者的个体剂量的计算必须基于含有0.44mg / ml擦干蛋白的即用型溶液的强度和1.23mg / m 2的剂量推荐值。以下所示的剂量降低建议也显示为根据即用型溶液的强度施用的擦伤剂的剂量。
在关键试验中,相应的出版物和其他一些地区,如美国和瑞士,推荐的剂量是基于盐形式(甲磺酸雷美布)。
患者可能会感到恶心或呕吐。应考虑止吐预防包括皮质类固醇。
治疗期间剂量延迟
以下任何情况,应在第1天或第8天延迟执行哈拉文管理局:
- 绝对中性粒细胞计数(ANC)<1×10 9 / l
- 血小板<75×10 9 / l
- 3级或4级非血液毒性。
治疗期间减少剂量
用于再次治疗的降低剂量的建议如下表所示。
减少剂量的建议
之前的哈拉芬给药后的不良反应
推荐剂量的eribulin
血液学:
ANC <0.5 x 10 9 / l持续7天以上
0.97 mg / m 2
ANC <1×10 9 / l中性粒细胞减少伴发热或感染
血小板<25×10 9 / l血小板减少症Halaven用法用量
血小板<50×10 9 / l血小板减少并发出血或血小板输注
非血液学:
任何3年级或4年级以上的周期
上述任何血液学或非血液学不良反应的复发
尽管减少到0.97毫克/米2
0.62mg / m 2
尽管减少到0.62毫克/米2
考虑停止
擦伤剂的剂量在降低后不应重新升级。
肝功能损害患者
转移性肝功能受损
在21天的第1天和第8天,2?5 分钟内静脉内给予轻度肝损伤患者(Child-Pugh A)的推荐剂量为0.97mg / m 2。布林患者中度肝损伤(Child-Pugh分级B)的推荐剂量为0.62毫克/米2第1天和第21天周期的第8静脉内给药历时2至5分钟。
严重的肝损伤(Child-Pugh C)尚未被研究,但是如果在这些患者中使用艾美菌素,则预期需要更明显的剂量减少。
由于肝硬化导致肝功能受损
该患者组尚未研究。上述剂量可用于轻度和中度损伤,但建议密切监测,因为剂量可能需要重新调整。
肾损害患者
一些中度或严重受损的肾功能(肌酸酐清除率<50 ml / min)的患者可能会增加擦伤素暴露,并可能需要减少剂量。对于所有患有肾损伤的患者,建议谨慎和密切的安全监测。(见第5.2节)
老年病人
根据病人的年龄不推荐进行特定的剂量调整(见4.8节)。
儿科人群
儿童和青少年中没有相关使用哈拉芬指征乳腺癌。
HALAVEN在出生到18岁的儿童中的安全性和疗效尚未建立在软组织肉瘤中。没有数据可用。
给药方法
HALAVEN用于静脉注射。剂量可以稀释至高达100ml氯化钠9mg / ml(0.9%)注射溶液。不应在葡萄糖5%输液中稀释。关于给药前药物稀释的说明,请参见6.6节。治疗前应确保良好的外周静脉通路或专利中心线。没有证据表明甲磺酸哌美酮是一种发泡剂或刺激物。在外渗的情况下,治疗应该是有症状的。有关细胞毒性药物处理的相关信息,请参见6.6节。
不良反应
(1)在转移性乳腺癌的患者中,最常见的不良反应(频率≥25%)为中性粒细胞减少症,贫血,疲劳,脱发,外周神经病变,恶心和便秘。
(2)在脂肪肉瘤和平滑肌肉瘤的患者中,最常见的不良反应(频率≥25%)为疲劳,恶心,脱发,便秘,外周神经病变,腹痛和发热。最常见的3-4级实验室检查异常(频率≥5%)为中性粒细胞减少症,低血钾症和低血钙症。
禁忌症
- 对活性物质或第6.1节中列出的任何赋形剂过敏
- 母乳喂养
【英文名称】 Halaven(eribulin mesylate)
【中文名称】 甲磺酸艾日布林,甲磺酸艾瑞布林
治疗适应症
HALAVEN用于治疗局部晚期或转移性乳腺癌的成年患者,其在至少一种用于晚期疾病的化疗方案后进展(参见5.1节)。先前的治疗应该在佐剂或转移性环境中包括蒽环类抗生素和紫杉烷,除非患者不适合这些治疗。
HALAVEN用于治疗不能切除的脂肪肉瘤的成年患者,其已接受先前使用蒽环类药物治疗(除非不适合)用于晚期或转移性疾病(见第5.1节)。
用法用量
HALAVEN只能在经过适当使用细胞毒性药用产品的合格医师的监督下进行。
剂量学
擦拭剂作为即用型溶液的推荐剂量为1.23mg / m 2,其应在每21天周期的第1天和第8天静脉注射2至5分钟。
请注意:
在欧盟,推荐剂量是指活性物质(eribulin)的基础。要给予患者的个体剂量的计算必须基于含有0.44mg / ml擦干蛋白的即用型溶液的强度和1.23mg / m 2的剂量推荐值。以下所示的剂量降低建议也显示为根据即用型溶液的强度施用的擦伤剂的剂量。
在关键试验中,相应的出版物和其他一些地区,如美国和瑞士,推荐的剂量是基于盐形式(甲磺酸雷美布)。
患者可能会感到恶心或呕吐。应考虑止吐预防包括皮质类固醇。
治疗期间剂量延迟
以下任何情况,应在第1天或第8天延迟执行哈拉文管理局:
- 绝对中性粒细胞计数(ANC)<1×10 9 / l
- 血小板<75×10 9 / l
- 3级或4级非血液毒性。
治疗期间减少剂量
用于再次治疗的降低剂量的建议如下表所示。
减少剂量的建议
之前的哈拉芬给药后的不良反应
推荐剂量的eribulin
血液学:
ANC <0.5 x 10 9 / l持续7天以上
0.97 mg / m 2
ANC <1×10 9 / l中性粒细胞减少伴发热或感染
血小板<25×10 9 / l血小板减少症Halaven用法用量
血小板<50×10 9 / l血小板减少并发出血或血小板输注
非血液学:
任何3年级或4年级以上的周期
上述任何血液学或非血液学不良反应的复发
尽管减少到0.97毫克/米2
0.62mg / m 2
尽管减少到0.62毫克/米2
考虑停止
擦伤剂的剂量在降低后不应重新升级。
肝功能损害患者
转移性肝功能受损
在21天的第1天和第8天,2?5 分钟内静脉内给予轻度肝损伤患者(Child-Pugh A)的推荐剂量为0.97mg / m 2。布林患者中度肝损伤(Child-Pugh分级B)的推荐剂量为0.62毫克/米2第1天和第21天周期的第8静脉内给药历时2至5分钟。
严重的肝损伤(Child-Pugh C)尚未被研究,但是如果在这些患者中使用艾美菌素,则预期需要更明显的剂量减少。
由于肝硬化导致肝功能受损
该患者组尚未研究。上述剂量可用于轻度和中度损伤,但建议密切监测,因为剂量可能需要重新调整。
肾损害患者
一些中度或严重受损的肾功能(肌酸酐清除率<50 ml / min)的患者可能会增加擦伤素暴露,并可能需要减少剂量。对于所有患有肾损伤的患者,建议谨慎和密切的安全监测。(见第5.2节)
老年病人
根据病人的年龄不推荐进行特定的剂量调整(见4.8节)。
儿科人群
儿童和青少年中没有相关使用哈拉芬指征乳腺癌。
HALAVEN在出生到18岁的儿童中的安全性和疗效尚未建立在软组织肉瘤中。没有数据可用。
给药方法
HALAVEN用于静脉注射。剂量可以稀释至高达100ml氯化钠9mg / ml(0.9%)注射溶液。不应在葡萄糖5%输液中稀释。关于给药前药物稀释的说明,请参见6.6节。治疗前应确保良好的外周静脉通路或专利中心线。没有证据表明甲磺酸哌美酮是一种发泡剂或刺激物。在外渗的情况下,治疗应该是有症状的。有关细胞毒性药物处理的相关信息,请参见6.6节。
不良反应
(1)在转移性乳腺癌的患者中,最常见的不良反应(频率≥25%)为中性粒细胞减少症,贫血,疲劳,脱发,外周神经病变,恶心和便秘。
(2)在脂肪肉瘤和平滑肌肉瘤的患者中,最常见的不良反应(频率≥25%)为疲劳,恶心,脱发,便秘,外周神经病变,腹痛和发热。最常见的3-4级实验室检查异常(频率≥5%)为中性粒细胞减少症,低血钾症和低血钙症。
禁忌症
- 对活性物质或第6.1节中列出的任何赋形剂过敏
- 母乳喂养

 京公网安备
11010802036025号
京公网安备
11010802036025号