药品概述
2020年01月13日,日本药企卫材(Eisai)近日宣布,该公司已在中国推出其自主研发的抗癌药Halaven(中文商品名:海乐卫,通用名:甲磺酸艾立布林,eribulin mesylate)。
在中国,被诊断为乳腺癌的女性人数近年来有所增加,乳腺癌已成为中国女性诊断高发癌症之一,2018年新增乳腺癌病例37万例,死亡10万例。
艾立布林是一种软海绵素类微管动力学抑制剂,具有独特的结合特性。除了抑制微管动力学生长的作用机制外,非临床研究显示,艾立布林对肿瘤微环境具有独特的作用,例如:增加肿瘤核心的血管灌注和通透性,促进上皮状态,降低乳腺癌细胞的迁移能力等。目前,艾立布林已在包括欧洲、美洲和亚洲在内的70多个国家和地区获得批准,用于乳腺癌的治疗。
在中国,艾立布林于2019年7月获得国家药品监督管理局(NMPA)批准,用于治疗既往接受过至少两种化疗方案(包括蒽环类和紫杉类)治疗的局部复发或转移性乳腺癌患者。
此次批准,基于3041研究的结果,这是一项多中心、开放性、随机、平行对照的III期临床研究,旨在评价艾立布林和长春瑞滨对530例局部复发或转移性乳腺癌女性患者的疗效及安全性,此类患者既往已接受包括蒽环类和紫杉类在内的化疗方案。在这项研究中,根据独立影像学审查显示,与长春瑞滨对照治疗组相比,艾立布林治疗组的主要终点,即无进展生存期(PFS)实现了统计学显著的延长(HR=0.80;95%CI:0.65-0.98;p<0.036)。
艾立布林组观察到五个最常见的不良事件为:白细胞计数降低、中性粒细胞计数降低、天门冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高以及贫血,此类事件与艾立布林的已知副作用一致。
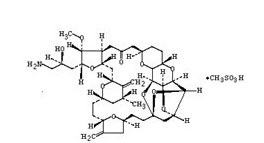
艾立布林是一种软海绵素类微管动力学抑制剂,具有新型的作用机制。从结构上来说,艾立布林为软海绵素B简化及合成的版本。软海绵素B为从海绵(黑色软海绵)中分离出的一种天然产物。艾立布林被认为通过抑制阻止细胞分裂的微管动力学的生长期发挥作用。此外,非临床研究显示了艾立布林在肿瘤微环境中的独特作用,如增加肿瘤核心区域的血管灌注和渗透性4,改善上皮细胞状态,降低乳腺癌细胞的迁移能力等。
2010年11月,艾立布林在美国首次获批用于治疗转移性乳腺癌患者。目前,包括欧洲、美洲和亚洲,超过65个国家和地区批准艾立布林用于治疗乳腺癌。此外,艾立布林于2016年1月在美国首次被批准用于治疗软组织肉瘤,随后在55个国家和地区获得批准。同时,艾立布林已在美国和日本被认定为治疗软组织肉瘤的孤儿药。
具体来说,艾立布林获批以下适应症:
——在美国,用于治疗:(1) 既往因为转移性疾病治疗而接受至少两种化疗方案的转移性乳腺癌患者。既往治疗应包括辅助或转移性疾病背景下的蒽环类药物和紫杉类。(2)既往接受过含蒽环类药物治疗的不可切除或转移性脂肪肉瘤患者。
——在日本,用于治疗:(1)不能手术的或复发性乳腺癌患者。(2)软组织肉瘤患者
——在欧洲,用于治疗以下成年患者:(1)既往接受过含蒽环类药物治疗晚期疾病的局部晚期或转移性乳腺癌患者。既往治疗应包括辅助或转移性疾病背景下的蒽环类药物和紫杉类,除非患者不适合接受这些治疗。(2)既往接受过含蒽环类药物治疗(除非不适用)晚期或转移性疾病的不可切除脂肪肉瘤患者。
在中国,被诊断为乳腺癌的女性人数近年来有所增加,乳腺癌已成为中国女性诊断高发癌症之一,2018年新增乳腺癌病例37万例,死亡10万例。
艾立布林是一种软海绵素类微管动力学抑制剂,具有独特的结合特性。除了抑制微管动力学生长的作用机制外,非临床研究显示,艾立布林对肿瘤微环境具有独特的作用,例如:增加肿瘤核心的血管灌注和通透性,促进上皮状态,降低乳腺癌细胞的迁移能力等。目前,艾立布林已在包括欧洲、美洲和亚洲在内的70多个国家和地区获得批准,用于乳腺癌的治疗。
在中国,艾立布林于2019年7月获得国家药品监督管理局(NMPA)批准,用于治疗既往接受过至少两种化疗方案(包括蒽环类和紫杉类)治疗的局部复发或转移性乳腺癌患者。
此次批准,基于3041研究的结果,这是一项多中心、开放性、随机、平行对照的III期临床研究,旨在评价艾立布林和长春瑞滨对530例局部复发或转移性乳腺癌女性患者的疗效及安全性,此类患者既往已接受包括蒽环类和紫杉类在内的化疗方案。在这项研究中,根据独立影像学审查显示,与长春瑞滨对照治疗组相比,艾立布林治疗组的主要终点,即无进展生存期(PFS)实现了统计学显著的延长(HR=0.80;95%CI:0.65-0.98;p<0.036)。
艾立布林组观察到五个最常见的不良事件为:白细胞计数降低、中性粒细胞计数降低、天门冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高以及贫血,此类事件与艾立布林的已知副作用一致。
艾立布林是一种软海绵素类微管动力学抑制剂,具有新型的作用机制。从结构上来说,艾立布林为软海绵素B简化及合成的版本。软海绵素B为从海绵(黑色软海绵)中分离出的一种天然产物。艾立布林被认为通过抑制阻止细胞分裂的微管动力学的生长期发挥作用。此外,非临床研究显示了艾立布林在肿瘤微环境中的独特作用,如增加肿瘤核心区域的血管灌注和渗透性4,改善上皮细胞状态,降低乳腺癌细胞的迁移能力等。
2010年11月,艾立布林在美国首次获批用于治疗转移性乳腺癌患者。目前,包括欧洲、美洲和亚洲,超过65个国家和地区批准艾立布林用于治疗乳腺癌。此外,艾立布林于2016年1月在美国首次被批准用于治疗软组织肉瘤,随后在55个国家和地区获得批准。同时,艾立布林已在美国和日本被认定为治疗软组织肉瘤的孤儿药。
具体来说,艾立布林获批以下适应症:
——在美国,用于治疗:(1) 既往因为转移性疾病治疗而接受至少两种化疗方案的转移性乳腺癌患者。既往治疗应包括辅助或转移性疾病背景下的蒽环类药物和紫杉类。(2)既往接受过含蒽环类药物治疗的不可切除或转移性脂肪肉瘤患者。
——在日本,用于治疗:(1)不能手术的或复发性乳腺癌患者。(2)软组织肉瘤患者
——在欧洲,用于治疗以下成年患者:(1)既往接受过含蒽环类药物治疗晚期疾病的局部晚期或转移性乳腺癌患者。既往治疗应包括辅助或转移性疾病背景下的蒽环类药物和紫杉类,除非患者不适合接受这些治疗。(2)既往接受过含蒽环类药物治疗(除非不适用)晚期或转移性疾病的不可切除脂肪肉瘤患者。
简要说明书
| 艾日布林|海乐卫eribulin (Halaven)说明书 | |
| 药物: | 艾日布林|海乐卫eribulin (Halaven) |
| 中国上市情况: | 已上市 |
| 治疗: | 治疗局部晚期或转移性乳腺癌的成年患者,治疗不能切除的脂肪肉瘤的成年患者。 |
| 参考用法用量: | 作为即用型溶液的推荐剂量为1.23mg / m 2,其应在每21天周期的第1天和第8天静脉注射2至5分钟。 |
| 不良反应: | 在转移性乳腺癌的患者中,最常见的不良反应(频率≥25%)为中性粒细胞减少症,贫血,疲劳,脱发,外周神经病变,恶心和便秘。 在脂肪肉瘤和平滑肌肉瘤的患者中,最常见的不良反应(频率≥25%)为疲劳,恶心,脱发,便秘,外周神经病变,腹痛和发热。 |

 京公网安备
11010802036025号
京公网安备
11010802036025号