药品概述
适应症:全球首款获批治疗复发或难治性PCNSL患者的BTK抑制剂。
剂型/给药途径:口服
国外批准日期:2020年3月日本批准
中国是否获批:否
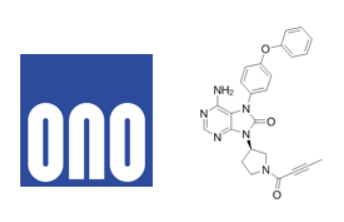
作用机制:一种高选择性口服BTK抑制剂
有效性数据:一项多中心,开放标签的1/2期临床研究ONO-4059-02的积极结果,该试验旨在评估Velexbru单药治疗复发或难治性PCNSL患者的疗效和安全性。研究结果表明,根据独立审查委员会(IRC)的评估,在空腹服用每日一次480 mg Velexbru治疗的17例患者中,患者的总缓解率(ORR)达到52.9%。
日本制药商小野制药(TYO:4528)已在日本获得生产和销售批准的Velexbru(替拉鲁替尼)片剂80mg(一种布鲁顿酪氨酸激酶(BTK)抑制剂),用于治疗复发性或难治性原发性中枢神经系统淋巴瘤。
获得批准的消息使小野公司的股票上涨7.9%,至2,286日圆,尽管市场在上涨。
该公司也被称为ONO-4059,该公司将tirabrutinib的许可证授予了吉利德科学公司(纳斯达克股票代码:GILD),从而使美国生物技术公司有权在除日本,中国和其他许多亚洲国家以外的所有国家/地区开发和商品化该产品。

该批准基于多中心,开放标签,未经控制的I / II期研究(ONO-4059-02)的结果,该研究评估了Velexbru对44例复发或难治性原发性中枢神经系统淋巴瘤患者的疗效和安全性(PCNSL),每天口服一次Velexbru。
在这项研究中,由独立审查委员会(IRC)评估的主要终点指标是,在经批准的禁食中接受480 mg Velexbru的17例患者中,总缓解率(ORR)为52.9%(9/17例)这次的剂量和用法。11.8%(2/17)的患者分别发生3-4级中性粒细胞减少,白细胞减少和高甘油三酯血症。
该批准表明,Velexbru是世界上第一个被批准用于治疗复发或难治性PCNSL的BTK抑制剂,而该国尚未建立任何护理标准。在2019年11月27日,Ono还提交了Velexbru在日本用于治疗Waldenstrom巨球蛋白血症(WM)和淋巴浆细胞性淋巴瘤(LPL)的申请。

 京公网安备
11010802036025号
京公网安备
11010802036025号