药品概述
KRAS是一种GTP结合蛋白,它可将受体酪氨酸激酶激活与细胞内信号传导相结合。KRAS G12C突变通常发生在约13%的肺癌患者、3%的结直肠癌和阑尾癌患者以及1%~3%的其他实体瘤患者中。目前还没有针对这种突变的治疗方案被批准。
AMG 510是一类新型的小分子,它通过将KRAS锁定在不活跃的GDP结合态,从而特异性地、不可逆地抑制KRAS。
临床数据
这是一个多中心、开放标签的Ⅰ期临床研究,首次在成人局部晚期或转移性KRAS G12C突变的实体瘤患者中进行,入组患者被证实有可测量或可评估的局部晚期或转移性KRAS G12C突变的实体瘤,且之前接受过针对肿瘤类型和疾病状态的标准化治疗,患者均无脑转移。
试验共入组35名患者,其中14名NSCLC患者,19名结直肠癌(CRC)患者,2名阑尾癌患者,有9名患者因疾病进展终止试验。试验共有29名可评估患者,其中10名NSCLC患者,18名CRC患者,1名阑尾癌患者。
35名患者随机分组,分别接受180mg、360mg、720mg、960mg剂量的 AMG510治疗。本次试验首要观察终点是AMG510的安全性和耐受性,包括不良反应和剂量限制性毒性(DLTs)的发生率,次要观察终点是客观反应率(ORR)、反应持续时间(DOR)和无进展生存期(PFS)。
入组患者的人群特征为:中位年龄55岁,40%男性,60%女性,88%白人,11%非白人,ECOG评分为0的患者占20%,ECOG评分为1 的患者占77%,ECOG评分为2的患者占3%,所有患者均接受过2种或以上的系统治疗。
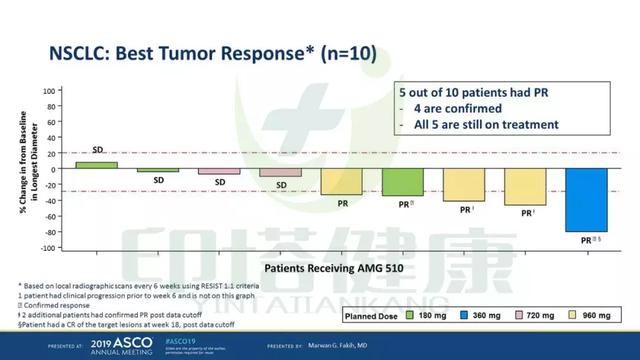
试验结果表明,10例NSCLC中有5例部分缓解,4例疾病稳定,仅1例疾病进展,ORR为50%,疾病控制率90%。5例部分缓解的患者仍在继续服药中。
19例结直肠癌等实体瘤患者中没有发现部分缓解的患者,14例患者稳定,5例进展,疾病控制率74%。

不良反应
AMG510最常见的不良反应有食欲下降、腹泻、疲劳、头痛、咳嗽、潮热、恶心。6名患者出现严重不良反应,包括两例3级不良反应(肺炎、恶性胆道梗阻)、一例4级不良反应(心包积液)、三例致命性不良反应(呼吸困难、结直肠癌转移)。这些不良反应与AMG510治疗无关。

与AMG510治疗相关的常见不良反应有腹泻、食欲下降、恶心、肌酸磷酸激酶升高、AST升高或改变、ALT升高或改变、碱性磷酸酶升高、唇炎、高钾血症、蛋白尿、口腔干燥症、胃肠胀气、呕吐、疲劳、白细胞减少、发热、关节炎、潮热。
与AMG510治疗相关的3级不良反应有贫血、腹泻;DLTs、4级药物相关不良反应以及严重药物相关不良反应在35名患者中没有出现。

小结
1、AMG510是一类新型的KRAS G12C不可逆抑制剂;
2、在35例患者中进行的的剂量水平测试证实AMG510是安全的,耐受性良好,没有观察到剂量限制性毒性,后续治疗期间未发现累积毒性;
3、初步观察到AMG510单药治疗KRAS G12C NSCLC患者的抗肿瘤活性,10例NSCLC患者中有5例部分缓解(4例已确认)。


 京公网安备
11010802036025号
京公网安备
11010802036025号