药品概述
盐酸拓扑替康胶囊,用于一线化疗失败的广泛期小细胞肺癌患者。采用盐酸拓扑替康+顺铂二线治疗,但尚缺乏数据支持本品可替代广泛期小细胞肺癌的一线治疗标准方案。
简要说明书
|
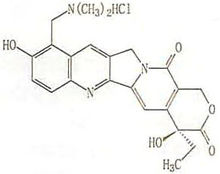
拓扑替康(Topotecan) 说明书
|
|
|---|---|
| 药物: | 盐酸拓扑替康胶囊 |
| 规格: | 按拓扑替康计算(1)0.25mg(2)1mg |
| 性状: | 本品为硬胶囊剂,内容物为淡黄色颗粒或粉末。 |
| 适应证: | 对于一线化疗失败的,采用盐酸拓扑替康+顺铂二线治疗,但不能耐受静脉给药的广泛期小细胞肺癌患者,可试用本品与顺铂联合治疗。 尚缺乏数据支持本品可替代广泛期小细胞肺癌的一线治疗标准方案。 |
| 临床应用: | |
| 不良反应: | 盐酸拓扑替康最常见的剂量限制性毒性反应为骨髓抑制,主要是中性粒细胞减少。口服给药和静脉给药的血液系统毒性主要有中性粒细胞减少、血小板减少和贫血,非血液学毒性主要有恶心、呕吐、脱发和腹泻。据国外口服给药和静脉给药临床研究表明,口服给药的血液学毒性Ⅲ-Ⅳ级中性粒细胞减少的发生率较静脉给药低。口服给药的非血液学毒性呕吐、腹泻、脱发可能较静脉给药多见。 1.国内研究 安全性分析数据来自于63例小细胞肺癌患者,主要观察到的不良反应如下: 血液系统毒性:在临床研究的63例病人中,82.5%的病人出现中性粒细胞减少,Ⅲ-Ⅳ级发生率为25.4%;88.9%的病人出现白细胞减少,Ⅲ-Ⅳ级发生率为12.7%;69.8%的病人出现血红蛋白减少,Ⅲ-Ⅳ级发生率为15.9%;44.4%的病人出现血小板减少,Ⅲ-Ⅳ级发生率为9.5%。 非血液学毒性主要有恶心、呕吐、脱发、便秘和腹泻。在临床研究的63例病人中,74.06%的病人出现恶心,其中Ⅲ级占6.4%;57.14%的病人出现呕吐,Ⅲ-Ⅳ级占11.11%;17.5%的病人出现Ⅰ级脱发;12.7%的病人出现Ⅰ-Ⅱ级便秘;11.1%的病人出现腹泻,其中1例(1.6%)为Ⅲ级。另有2例口腔炎、1例头晕、1例皮疹.个别病人出现肝酶升高。 2.国外研究 对389例接受口服拓扑替康/顺铂治疗的广泛期小细胞肺癌初治患者进行安全性分析,结果:血液学毒性方面,Ⅳ级中性粒细胞减少的发生率为26%,Ⅳ级血小板减少的发生率为8.7%,Ⅲ-Ⅳ级贫血的发生率为37.3%,Ⅳ级中性粒细胞减少伴随发热/感染的发生率为3.9%,脓血症的发生率为4.2%;非血液学毒性主要有Ⅲ级恶心(3.9%、Ⅲ-Ⅳ级呕吐(4.5%)、Ⅲ-Ⅳ级腹泻(5.8%)和Ⅲ-Ⅳ级厌食(3.7%)。 3.盐酸拓扑替康静脉给药观察到的不良反应 盐酸拓扑替康静脉给药时观察到的不良反应也可能会出现在口服给药途径,包括血液系统毒性有白细胞减少、血小板减少、贫血等反应,消化系统有恶心、呕吐、腹泻、便秘、肠梗阻、腹痛、口腔炎、厌食。脱发,偶见严重的皮炎及搔痒:头痛,关节痛,肌肉痛,全身痛,感觉异常,呼吸困难,乏力,不适,发热,有时出现肝功能异常,转氨酶升高,罕见过敏反应及血管神经性水肿。 |
| 参考用法用量: | 口服给药,与顺铂联用。推荐剂量为每日一次,每次接体表面积1.4mg/m2,连续服用5天,在第5天给予顺铂(75mg/m2)静脉输注,每21天为一个疗程。可根据患者耐受性调整本品剂量,调整原则: 1.治疗中出现3级血液学毒性,下一周期剂量可减少25%。如出现4度粒细胞减少合并严重感染性发热则中止治疗。 2.治疗中胆红素异常者推迟两周,如仍未恢复则停止用药。 3.肝功能转氨酶大于正常值2.5倍时,下一周期剂量减少25%,大于5倍时停止用药。 4.治疗中出现肾功能毒性1级,下一周期剂量减少25%,如出现2级毒性则中止治疗。 单独用药剂量尚未进行研究。 |
| 用药禁忌: | 1.对拓扑替康及本品其他成份有过敏史的病人禁用; 2.孕妇、哺乳期妇女禁用; 3.患有严重骨髓抑制,中性粒细胞<1500个/mm3病人禁用。 |
| 注意事项: | 警告: 本品必须在有盐酸拓扑替康静脉应用经验的肿瘤化疗医生的指导和观察下使用,为及时有效地处理相关不良事件,应在诊断和治疗设施齐备的条件下使用本品。 1.对接受本品治疗的患者,必须定期监测外周血常规,以便及早发现骨髓抑制现象。骨髓抑制主要表现为中性粒细胞减少,严重时可并发感染,甚至死亡。治疗中只有当中性粒细胞数恢复至1500个/mm3以上,血小板数至100,000个/mm3以上,血红蛋白水平至9.0g/dl以上(必要时可输血)时,病人方可继续使用。 2.肝功不全(血浆胆红桑1.5~10mg/dl)的病人,血浆清除率降低,但一般不需调整剂量。 3.轻度肾功能不全(肌酐清除率40~60ml/min)的病人一般不需调整剂量,中度肾功能不全(肌酐清除率20~39ml/min)的病人应减少剂量,没有足够资料证明严重肾功能不全者可否使用。 |
| 药物相互作用: | 1.本品与其他抗肿瘤药物合用能提高细胞毒性,其提高 程度与肿瘤类型、暴露时间、药物浓度和用药顺序有关。 2.本品与其他细胞毒性药物合用时,可能会加重骨髓抑 制情况,因此可考虑适当减少剂量。 |
| 药理毒理: | 盐酸拓扑替康为拓扑异构酶Ⅰ的抑制剂。拓扑异构酶Ⅰ通过诱导DNA单链可逆性断裂,使DNA螺旋链松解,拓扑替康与拓扑异构薛Ⅰ-DNA复合物结合,从而阻碍断裂的DNA单链重新连接。拓扑替康与拓扑异构酶Ⅰ和DNA形成的三元复合物与复制酶相互作用,造成双链DNA的损伤,而哺乳动物的细胞无法有效修复损伤的DNA双链。其细胞毒作用是在DNA的合成过程中,是S期细胞周期特异性药物。 盐酸拓扑替康具有较强抗肿瘤活性和广泛的抗瘤谱,临床前体内抗瘤试验表明,对L1210及P388白血病、B16黑色素瘤、B16/F10黑色素瘤亚株、Lewis肺癌、ADJ-PC6浆细胞瘤、结肠癌38和51、M5076肉瘤、乳腺癌16/C、Wadison肺癌等多种动物移植性肿瘤模型有明显抗肿瘤作用。 拓扑替康对哺乳动物细胞具有生殖毒性,并可能有致癌作用。拓扑替康能诱导L5178y小鼠淋巴瘤细胞突变和培养的人淋巴细胞发生裂变,还可引起小鼠骨髓裂变。微生物回复突变试验为阴性。 |
| 药代动力学: | 本品尚缺乏在中国人进行的药代动力学研究。 拓扑替康内酯结构存在可逆的pH依赖性水解过程,其内酯型具有药理活性作用。pH≤4时,拓扑替康以内酯型存在,而在生理pH条件下,以开环的羟基酸形式为主。 国外对18例实体瘤患者的一项药代动力学研究中,采用双周期交叉设计,患者在第1个疗程的第1天,空腹或食用高脂肪食物后口服拓扑替康2.3mg/m2/天,第2天两组交叉接受进食或空腹方案:第2个疗程则第1天空腹口服拓扑替康2.3mg/m2或静脉给药1.5mg/m2,第2天交叉接受静脉或口服给药;两个疗程的第3~5天均口服给药。 结果,拓扑替康的绝对生物利用度平均为42±13%,口服给药的平均终末半衰期(3.9±1.0小时)长于静脉给药(2.7±0.4小时)。空腹与食用高脂肪食物后服药的AUC比值为0.93±0.23,空腹与进食的峰值血药浓度分别为(9.2±4.1ng/ml)和(10.6±4.4ng/ml),达峰时间分别为2.0小时和3.1小时。 本品主要经肾脏排泄,约30%经尿排泄。肾功能不全的病人对本品的血浆清除率下降,半衰期延长;肝功能不全的病人对本品的代谢和毒性与正常人无显著差异。本品可通过血脑屏障。 |

 京公网安备
11010802036025号
京公网安备
11010802036025号